Vous devez effectuer une série de tests sur deux types de jus : un jus frais (en sortie de presse) et un jus pasteurisé.
Pour cela vous devez avoir à disposition une bouteille d’un jus pasteurisé et un prélèvement d’environ 500 ml de jus frais.
Les tests sont les suivants :
Analyse sensorielle
Mesure de l’acidité
Par pH métrie
Par volumétrie
Détermination de la teneur en sucre
Dosage de la vitamine C
Détermination de la teneur en calcium
Dénombrement de la flore totale.
- Test N°1 : Analyse sensorielle.
- Deux opérateurs doivent gouter et évaluer le jus pasteurisé selon AQPrPF 21.
- Compléter la fiche de l’analyse sensorielle correspondante.
2- Test N°2 : Détermination de l’acidité totale.
2-1 : Test N°2-1 : par pH-métrie.
2-1-1 : Protocole.
A l’aide d’un pHmètre étalonné et selon AQPrPF 06, mesurer le pH du jus en sortie de presse (jus frais) et sur le jus pasteurisé.
2-1-2 : Analyse des résultats.
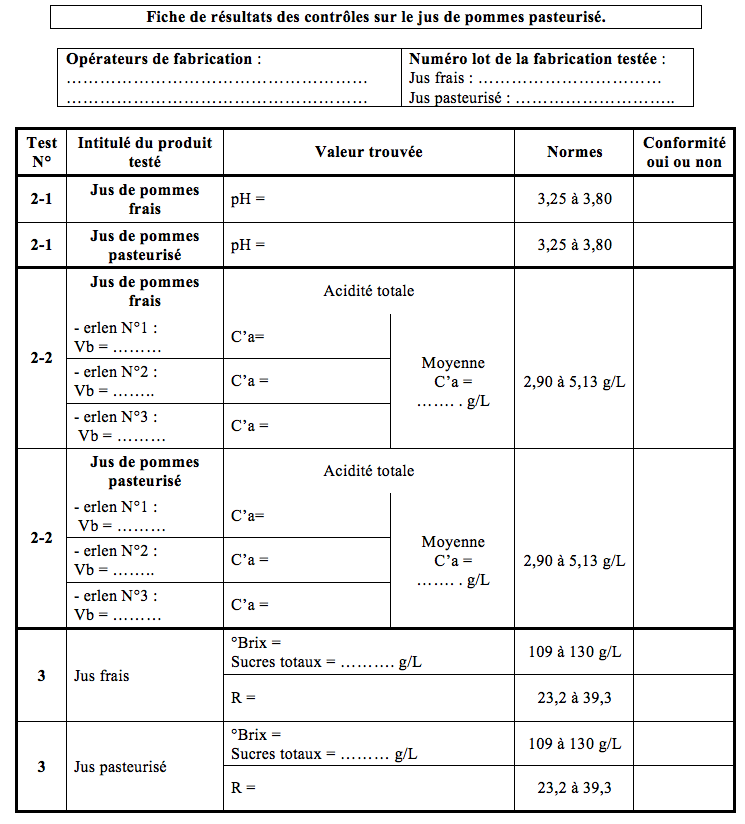
Le jus est conforme si le pH est compris entre 3,25 et 3,80.
Compléter la fiche de résultats.
2-2 : Test N°2-2 : par volumétrie.
Le contrôle se fait sur le jus en sortie de presse (jus frais) et sur le jus pasteurisé.
2-2-1 : Principe :
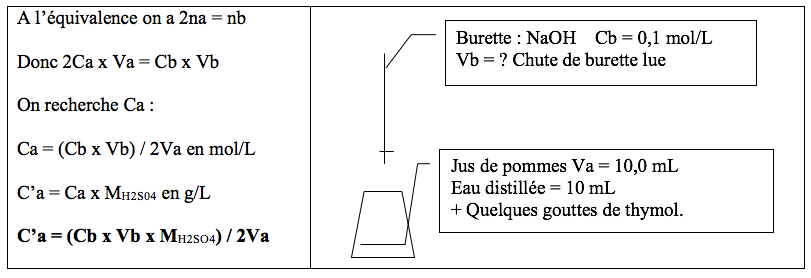
Il s’agit de déterminer la concentration massique en H2SO4du jus. On dose l’acide avec de la soude NaOH à Cb = 0,1 mol/L.
Réaction chimique :
H2S04+ 2 NaOH → 2 H2O + SO42-+ 2Na+
2-2-2: Matériel et produits nécessaires.
- Echantillon de jus à tester. Jus frais et jus pasteurisé.
- Solution de soude (NaOH) à Cb = 0,1 mol/L.
- Le bleu de thymol qui est rose en milieu acide et devient bleu quand toute l’acidité du jus est neutralisée par la soude.
- Eau distillée.
- Une burette de 25 mL.
- Une pipette jaugée de 10 mL.
- Une éprouvette de 25 mL.
- 3 erlens de 250 mL.
- 1 propipette pour pipette de 10 mL.
2-2-3 : Protocole.
Dans chaque erlen introduire :
- 10,0 mL de jus de pommes frais mesurés à la pipette jaugée ;
- 10 mL d’eau distillée mesurés à l’éprouvette.
- Quelques gouttes de bleu de thymol.
Dans la burette introduire la solution de soude à 0,1 mol/L, et ajuster le zéro.
Pour chaque erlen,
- Faire couler doucement la soude dans l’erlen, en agitant constamment, jusqu’au virage au rose (léger) de l’indicateur.
- Noter le volume Vb correspondant à chaque chute de burette, et compléter la fiche de résultats
FAIRE LA MESURE TROIS FOIS.
Nettoyer les erlens, les rincer à l’eau distillée, et recommencer toutes les opérations de dosage avec du jus pasteurisé.
2-2-4 : Analyse des résultats :
- Pour chaque chute de burette Vb, calculer C’a = concentration massique en H2S04 selon la formule suivante :
- C’a = (Cb x Vb x MH2SO4) / 2 Va.
Avec MH2SO4= 98,1 g/mol
- Compléter la fiche de résultats.
- Faire la moyenne des deux plus proches valeurs, compléter la fiche de résultats.
Le jus est conforme si la concentration massique C’ad’H2S04 est comprise entre 2,90 et 5,13 g/L.
- Compléter la fiche de résultats.
- Conclure sur la conformité du jus, compléter la fiche de résultats.
3- Test N°3 : Détermination de la teneur en sucres totaux par réfractométrie.
3-1 : Principe :
Il s’agit de déterminer la teneur en sucre par réfractométrie. Pour cela on réalise une courbe d’étalonnage grâce à des solutions de sucre dont les concentrations sont connues. A l’aide de cette courbe, et après avoir lu le degré Brix du jus de pommes, on peut déterminer le taux de sucre du jus.
3-2 : Matériel et produits nécessaires :
- Un réfractomètre numérique propre et sec.
- Eau distillée.
- Solutions de saccharose étalons à 80, 100, 120, 140, 160 et 180 g/L.
- Echantillon de jus frais.
- Echantillon de jus pasteurisé.
3-3 : Protocole.
- Nettoyer et préparer un réfractomètre numérique selon AQPrMa 29.
- Entre chaque lecture, le réfractomètre doit être nettoyé à l’eau distillée.
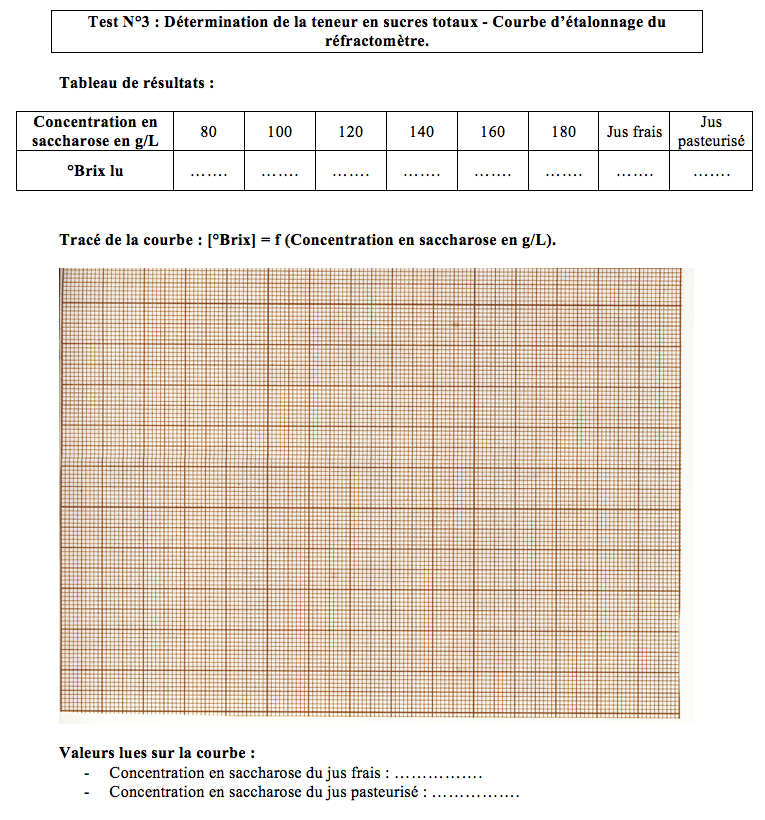
- Faire la lecture des degrés Brix de chacune des solutions étalons de sucres suivantes : 80, 100, 120, 140, 160 et 180 g de saccharose par litre de solution.
- Relever les résultats et compléter le tableau de la fiche de résultats.
- Faire la lecture du degré Brix du jus frais. Noter le résultat et compléter la fiche de résultats.
- Faire la lecture du degré Brix du jus pasteurisé. Noter le résultat et compléter la fiche de résultats.
3-4 : Analyse des résultats.
- Tracer la courbe d’étalonnage [°Brix] = f (Concentration en saccharose en g/L) sur le papier millimétré.
- Reporter sur la courbe les valeurs des indices (degré brix) des jus frais et pasteurisé.
- Déduire de la courbe la valeur de la concentration des deux jus en g de saccharose par litre de jus.
- Compléter la fiche de résultats.
Le jus est conforme si la teneur en sucres totaux est comprise entre 109 et 130 g/L.
Calculer : R = Sucre totaux en g/L / C’aH2S04en g/L
R représente la teneur en sucre masquant l’acidité du jus et qui lui garantit ses qualités gustatives.
Le jus est conforme si R est compris entre 23,2 et 39,3.
4- Test N°4 : Dosage de la vitamine C.
La vitamine C est l’isomère L de l’acide ascorbique. C’est un acide carboxylique dérivé d’un hexose.
4-1 : Caractérisation de la vitamine C.
Dans un tube à essai, introduire :
- 2 mL de liqueur de Felhing solution A.
- 2 mL de liqueur de Felhing solution B.
- 4 mL de jus de pommes frais.
Porter à ébullition.
Observer.
Si la réaction est positive (couleur orange) réaliser le dosage, car il y a présence d’un sucre réducteur.
Si la réaction est négative (couleur bleue) le dosage est inutile.
Refaire le test sur le jus de pommes pasteurisé.
4-2 : Dosage de la vitamine C.
4-2-1 : Principe.
Il s’agit d’une réduction du 2-6 dichlorophénolindophénol (2-6 DPI), selon la réaction suivante :
Vitamine C + 2-6 DPI (Bleu) → Vitamine C réduite + leucodérivé (rouge).
Le 2-6 DPI est bleu en milieu neutre ou alcalin et rouge en milieu acide, c’est sur cette propriété qu’est basé ce dosage volumétrique.
4-2-2 : Matériel et produits nécessaires.
- Echantillon de jus à tester. Jus frais et jus pasteurisé.
- Solution mère de DPI à 0,2 g/L.
- Solution d’acide phosphorique à 20 g/L.
- Eau distillée.
- Une fiole jaugée de 100 mL.
- Une burette de 25 mL.
- 2 pipettes jaugées de 10 mL.
- 2 éprouvettes de 25 mL.
- 3 erlens de 250 mL.
- Une propipette pour pipette de 10 mL.
4-2-3 : Protocole.
a) Dilution de la solution mère de DPI.
La solution mère de DPI est à 0,2 g/L. la solution de DPI utilisée pour ce dosage doit être à 0,02 g/L. Il faut donc diluer au 1/10èmela solution mère.
- Nettoyer à l’eau distillée une fiole jaugée de 100 mL.
- Introduire 10,0 mL de la solution mère de DPI à 0,2 g/L, dans la fiole jaugée, à l’aide d’une pipette jaugée de 10,0 mL.
- Compléter au trait de jauge avec de l’eau distillée.
- Agiter. On obtient une solution fille de DPI à 0,02 g/L
b) Dosages :
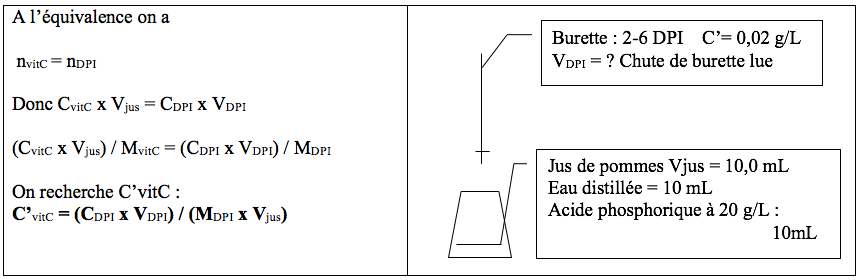
Dans chaque erlen introduire :
- 10,0 mL de jus de pommes frais mesurés à la pipette jaugée ;
- 10 mL d’eau distillée mesurés à l’éprouvette.
- 10 mL d’acide phosphorique à 20 g/L mesuré à l’éprouvette.
Dans la burette introduire la solution fille de 2-6 DPI à 0,02 g/L, et ajuster le zéro.
Pour chaque erlen,
- Faire couler doucement le DPI dans l’erlen, en agitant constamment, jusqu’à l’apparition d’une coloration rose persistante.
- Noter le volume VDPIcorrespondant à chaque chute de burette, et compléter la fiche de résultats
FAIRE LA MESURE TROIS FOIS.
Nettoyer les erlens, les rincer à l’eau distillée, et recommencer toutes les opérations de dosage avec du jus pasteurisé.
4-2-4 : Analyse des résultats :
- Pour chaque chute de burette VDPI, calculer C’vitC= concentration massique en vitamine C selon la formule suivante :
C’vitC= (C’DPIx VDPIx MvitC) / (MDPIx Vjus)
Avec :
- C’DPI= 0,02 g/L,
- MvitC= 176 g/mol,
- MDPI= 259 g/mol,
- VDPI= Volume de chute de burette de DPI en L.
- Vjus= Volume de prise d’essai du jus de pommes en litre = 10.10-3.
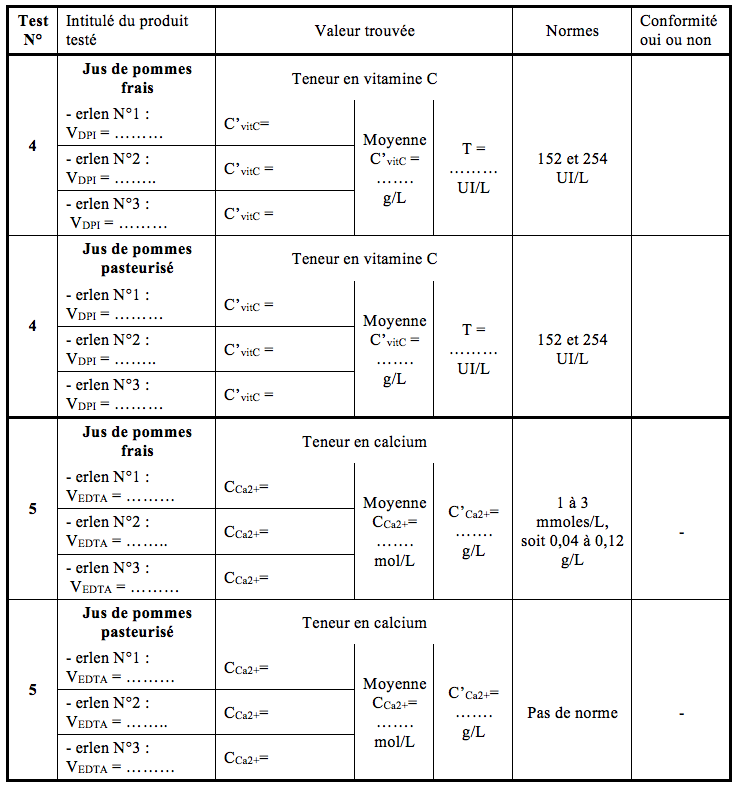
- Compléter la fiche de résultats.
- Faire la moyenne des deux plus proches valeurs, compléter la fiche de résultats.
- Calculer le titre du jus de pommes en vitamine C, sachant que 1 unité internationale de vitamine C ‘(U.I.) correspond à 0,05 mg d’acide ascorbique cristallisé. On en déduit le titre UI de 1 litre de jus de pommes.
T = C’vitC/ 0,05 en UI/L de jus.
- Compléter la fiche de résultats.
Le jus est conforme s’il contient entre 152 et 254 UI/L.
- Conclure sur la conformité du jus, compléter la fiche de résultats.
5- Test N°6 : Détermination de la teneur en calcium par compléxométrie.
5-1 : Principe :
Au cours de ce dosage, on cherche à complexer le calcium du jus de pommes par un réactif de complexation : l’EDTA.
Le réactif EDTA est utilisé quantitativement. Une molécule d’EDTA complexant une molécule de calcium, ni l’ion EDTA, ni l’ion calcium, n’étant colorés, il faut donc un indicateur coloré de présence. Cet indicateur est le Patton et Reeder :
- Qui est rose s’il y a des ions calcium libres.
- Bleu/vert si tous les ions calcium ont été complexés par l’EDTA.
5-2 : Matériel et produits nécessaires.
- Echantillon de jus à tester. Jus frais et jus pasteurisé.
- Solution mère de d’EDTA.
- Solution de NaOH à 2 M.
- Indicateur de Patton et Reeder.
- Eau distillée fraiche(vider la pissette et la remplir si nécessaire).
- Une fiole jaugée de 100 mL.
- Une burette de 25 mL.
- une pipette jaugée de 10 mL.
- une éprouvette de 50 mL.
- 3 erlens de 250 mL.
- Une propipette pour pipette de 10 mL.
- Une pipette graduée de 2 mL avec sa propipette.
- Une petite spatule.
5-3 : Protocole.
5-3-1 : Dilution de la solution mère d’EDTA.
La solution mère d’EDTA est à 0,1 mol/L. La solution d’EDTA utilisée pour ce dosage doit être à 0,01 mol/L. Il faut donc diluer au 1/10èmela solution mère.
- Nettoyer à l’eau distillée une fiole jaugée de 100 mL.
- Introduire 10,0 mL de la solution mère d’EDTA à 0,1 mol/L, dans la fiole jaugée, à l’aide d’une pipette jaugée de 10,0 mL.
- Compléter au trait de jauge avec de l’eau distillée.
- Agiter. On obtient une solution fille d’EDTA à 0,01 mol/L
5-3-2 : Dosages :
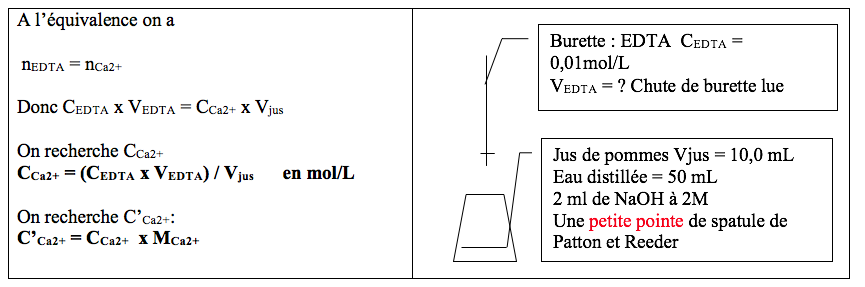
Dans chaque erlen introduire :
- 10,0 mL de jus de pommes frais mesurés à la pipette jaugée ;
- 50 mL d’eau distillée mesurés à l’éprouvette.
- 2 mL de soude (NaOH) 2M mesuré à la pipette graduée avec une propipette.
- Une petite pointede spatule d’indicateur de Patton et Reeder.
Dans la burette introduire la solution fille d’EDTA à 0,01 mol/L, et ajuster le zéro.
Pour chaque erlen,
- Faire couler doucement l’EDTA dans l’erlen, en agitant constamment, jusqu’à la disparition de la coloration rose et l’apparition d’une coloration bleu-vert persistante.
- Noter le volume VEDTAcorrespondant à chaque chute de burette, et compléter la fiche de résultats
FAIRE LA MESURE TROIS FOIS.
Nettoyer les erlens, les rincer à l’eau distillée, et recommencer toutes les opérations de dosage avec du jus pasteurisé.
5-4 : Analyse des résultats :
Pour chaque chute de burette VEDTA, calculer CCa2+= concentration molaire en ion calciumselon la formule suivante : CCa2+= (CEDTAx VEDTA) / Vjus, en mol/L
Avec :
- CEDTA= 0,01 mol/L,
- VEDTA= Volume de chute de burette de EDTA en L.
- Vjus= Volume de prise d’essai du jus de pommes en litre = 10.10-3.
- Compléter la fiche de résultats.
- Faire la moyenne des deux plus proches valeurs, compléter la fiche de résultats.
- Calculer C’Ca2+= concentration massique en ions calcium selon la formule suivante: C’Ca2+= CCa2+ x MCa2+
Avec :
- CCa2+= valeur moyenne de la concentration molaire en ion calcium du jus,
- MCa2+= Masse molaire du calcium = 40,1 g/mol.
- Compléter la fiche de résultats.
Il n’existe pas de norme pour la teneur en calcium des jus de fruits.
6- Test N°6 : Analyse bactériologique du jus de pommes pasteurisé.
- Appliquer la procédure AQPrPF 05 sur le jus pasteurisé.
- Compléter la fiche de suivi bactériologique de la procédure AQPrPF05
- Appliquer la norme relative au lait pasteurisé.